便秘とLPS泛菌糖脂质
注:
本文为中、日、英三种语言,下方附有中文翻译,供您查阅!
便秘とLPS
Constipation and LPS
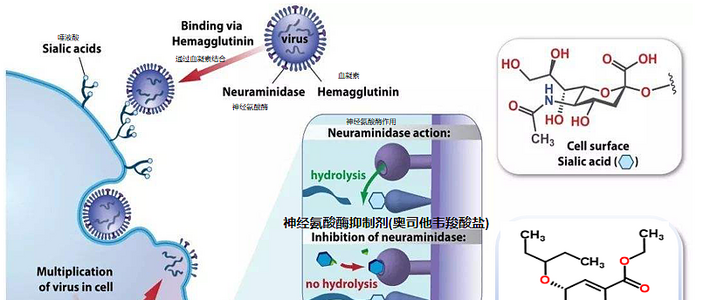
腸内細菌由来のLPSは腸の蠕動運動に関係することが報告されています。
ヒトの体の細胞数よりもはるかに多い数、100兆個もいると言われる腸内細菌ですが、このうち、少なくとも半数はLPSを持つグラム陰性細菌です。腸内のグラム陰性細菌から遊離するLPSが腸の筋肉マクロファージに作用すると、BMP2という物質を出して腸の神経細胞を刺激します(*1)。すると神経細胞は外筋層に蠕動を促します。こうして、腸内のLPSは腸の蠕動運動、つまり便秘の予防にも係っています。
腸内細菌のLPSは腸を蠕動させる
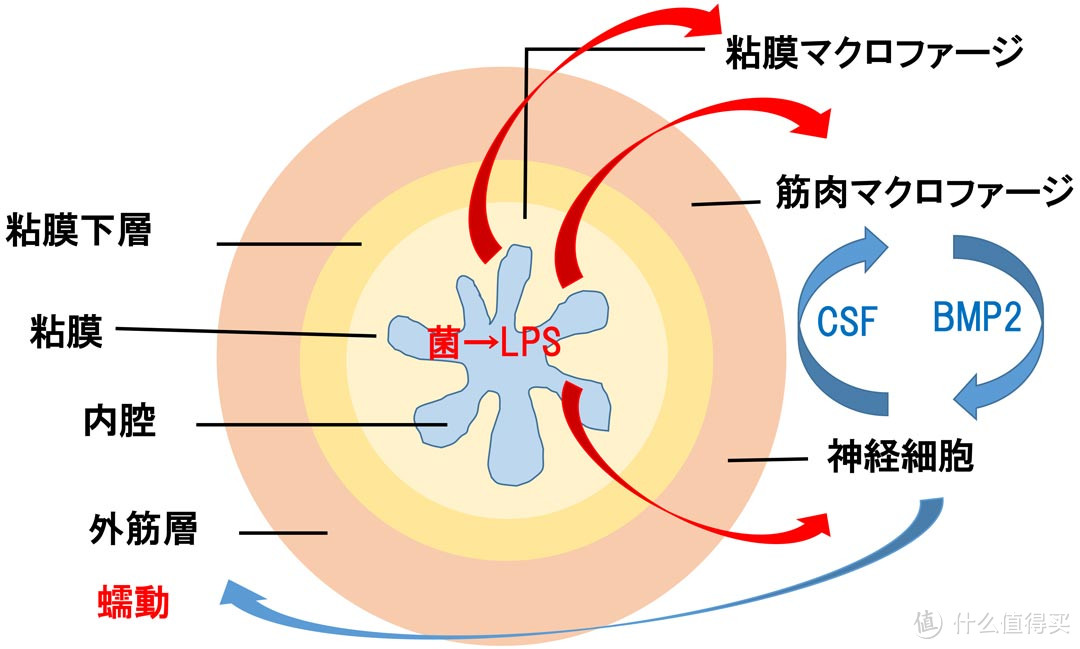
(*1)Crosstalk between Muscularis Macrophages and Enteric Neurons Regulates Gastrointestinal Motility, Cell 158: 300-313 (2014)
中文翻译:
据报道,来自肠道细菌的LPS泛菌糖脂质与肠道蠕动有关。
肠道中的细菌数量据说比人体细胞还要多,多达100万亿个,其中至少有一半是携带LPS的革兰氏阴性细菌。肠道革兰氏阴性细菌释放的LPS作用于肠道平滑肌细胞,通过产生一种名为BMP2的物质来刺激肠道神经元(*1)。这样,神经元会促进外层肌肉层的蠕动。因此,肠道中的LPS与肠道蠕动,即预防便秘有关。
肠道细菌的LPS能够促进肠道蠕动

( *1) cross talk between macrophages and enteric neurons regulates gastro intestinal motility,Cell 158: 300-313 (2014 )
以下内容为文献详情内容
原文内容:
An update to this article is included at the end
中文翻译:
肌层巨噬细胞和肠神经元之间的交流调节胃肠道动力
作者:
保罗·安德鲁·穆勒,1,2,3,10 巴拉兹·科斯科,7 高拉夫·马诺哈尔·拉贾尼,7 科里·斯捷潘诺维奇,8 玛丽-路易丝·贝雷斯,1,2,3 大河原,1,2,3,13 亚瑟·莫尔塔,1,2,3 玛丽琳·勒布夫,1,2,3 秀敏·李,5,6 丹尼尔·穆西达,10 E.理查德·斯坦利,11 斯蒂芬妮·达汉,3,4 卡拉·格罗斯·马戈利斯,8 迈克尔·大卫·格什龙,9 米里亚姆·梅拉德,米尔亚姆·梅拉德,1,2,3,12,* 和 米莱娜·博古诺维奇1,2,3,7,12,*
1.肿瘤科学系
2.蒂施癌症研究所
3.免疫学研究所
4.临床医学免疫学系,医学系
5.儿科过敏与免疫学系
6.贾菲食物过敏研究所
7.西奈山医学院,纽约,纽约州10029,美国
8.微生物学与免疫学系,宾夕法尼亚州立大学医学院和米尔顿·赫尔希医疗中心,赫尔希,宾夕法尼亚州170333,美国
9.儿科系,摩根·斯坦利儿童医院
10.病理学与细胞生物学系,哥伦比亚大学医学院和外科医生,纽约,纽约州10032,美国
11.粘膜免疫学实验室,洛克菲勒大学,纽约,纽约州10065,美国
12.发育与分子生物学系,阿尔伯特·爱因斯坦医学院,布朗克斯,纽约州10461,美国
13.日本北海道大学医学研究生院血液学系
摘要
肠道蠕动是一个受饮食和微生物变化影响的动态生理过程。它受到复杂细胞相互作用的严密调控;然而,我们对这些控制的理解还不完整。肌肉巨噬细胞在肠道外肌层中分布。我们证明,在稳定状态下,肌肉巨噬细胞调节结肠的蠕动活性。它们通过分泌骨形态发生蛋白2(BMP2),激活肠神经元表达的BMP受体(BMPR)来改变平滑肌收缩的模式。肠神经元反过来分泌集落刺激因子1(CSF1),这是巨噬细胞发育所需的生长因子。最后,微生物群落的刺激通过巨噬细胞调节BMP2的表达和肠神经元的CSF1表达。我们的发现确定了一种可塑性、由微生物群驱动的肌肉巨噬细胞与肠神经元之间的交流,这种交流控制着胃肠道动力。
引言
肠道的蠕动对于推动摄入的物质通过胃肠道(GI)至关重要。这些运动是由形成肌肉外层的环形和纵向平滑肌的协调收缩和松弛产生的(图1A)。蠕动收缩的模式和频率由肠神经系统(ENS)和Cajal间质细胞(ICCs)局部调节。单核吞噬细胞,包括树突细胞(DCs)和巨噬细胞,构成了大多数组织中发现的异质性髓样细胞的异质性群体。它们的共同功能是通过清除和参与免疫反应来维持组织稳态(Hashimoto et al., 2011b)。在小鼠和人类的肠道肌肉中存在一个MHCII*巨噬细胞网络(Mikkelsen and Rumessen, 1992; Mikkelsen et al., 1985)。这个网络从胃延伸到远端结肠(Mikkelsen, 2010)。在肌肉层内,这些巨噬细胞主要积累在层间,位于浆膜和纵向肌之间,位于纵向和环形肌之间,以及外环和内环肌之间(Mikkelsen, 2010)。除了它们的吞噬特性(Mikkelsen et al., 1985),肌肉巨噬细胞(MMs)是强效抗原呈递细胞有时被称为树突细胞(DCs)(Flores-Langarica 等人,2005年)。
图1.MHCIICX3CR1 巨噬细胞(MMs)需要CSF1R信号来发育
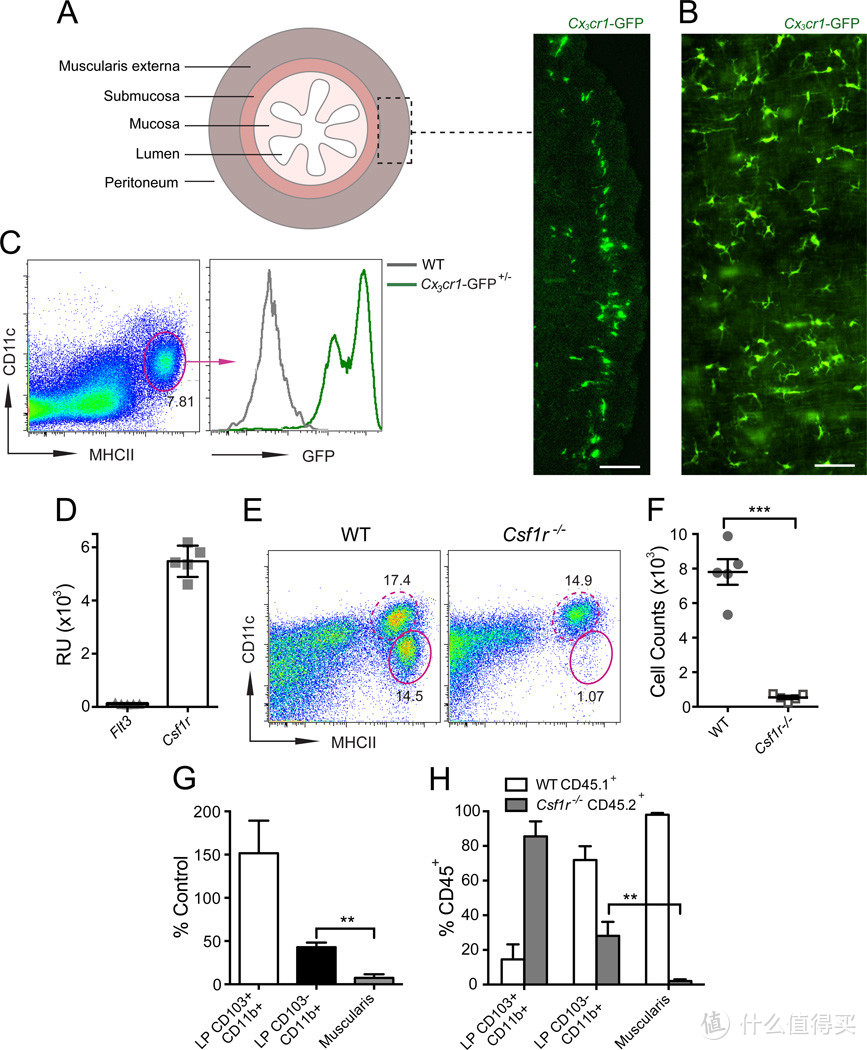
(A 和 B) 在Cx3cr1-GFP+/-小鼠的肠道平滑肌层(LB)的横截面(A)和肌肉层(B)中显示CX3CR1* MMs的分布。比例尺,100纳米。
(C) 通过荧光激活细胞分选(FACS)分析(基于DAPI细胞)Cx3cr1-GFP+小鼠的肠道平滑肌层(SB)中的MMs的表型。
(D) 通过小鼠基因表达微阵列测量并呈现为相对单位(RU)的分选MMs中的Fit3和Csf1r表达。数据以平均值±标准误(SEM)呈现。
(E) 来自WT或Csf1r小鼠的全肠悬浮液的FACS图显示CD11cMHCII* MMs(椭圆形门,实线)和CD11cMHCII LP吞噬细胞(椭圆形门,虚线)的百分比。基于图S1中展示的CD45*CD11c/h/CD11b/h/细胞进行门控。
(F) 通过FACS(平均值±SEM)量化WT和Csf1r小鼠整个肠道中的MMs的绝对数量。
(G) 与WT同胞相比,Csf1r小鼠中MMs和CD103+CD11b和CD103CD11b LP吞噬细胞的相对减少(通过FACS量化,平均值±SEM)。
(H) 来自10% WT+ 90% Csf1r混合骨髓嵌合体的SB中WT CD45.1和Csf1r CD45.2细胞在CD45* CD103CD11b和LP CD103CD11b吞噬细胞和MMs(肌肉)中的百分比(平均值±SEM)。另见图S1。
与它们的黏膜对应物相比,肌肉巨噬细胞(MMs)的功能要少得多。一些研究表明,MMs与术后肠梗阻的发病机制有关,肠梗阻是一种短暂的胃肠道炎症状态,可导致肠麻痹(Mikkelsen,2010)。在手术操作的肠道区域,激活的MMs释放的炎症介质被认为通过直接影响平滑肌的收缩性以及通过招募额外的炎症细胞(Boeckstans和de Jonge,2009年;Wehner 等人,2007年)来损害肠道蠕动性。然而,MMs是否在调节构成性肠道生理中发挥作用,这一点尚未确定。受到这些细胞的独特分布的启发,以及由巨噬细胞是组织稳态的关键调节者这一观点的驱动(Chow 等人,2011年,2013年;Wynn 等人,2013年),我们假设MMs可能为平滑肌细胞提供营养支持,并通过这种支持调节构成性肠道蠕动。
为了测试我们的假设,我们开发了一个选择性短暂耗尽巨噬细胞(MMs)的模型。然后我们证明了巨噬细胞在稳定状态下调节肠道蠕动,并且确定了一种特定的因子BMP2,这种因子由巨噬细胞分泌,并通过直接作用于肠神经元而非平滑肌来调节肠道蠕动性。我们的工作揭示了MMs和肠神经元之间的相互交流。MMs通过提供BMP2支持肠内神经元,而神经元通过产生巨噬细胞特异性生长因子CSF1来促进MMs的稳态。最后,我们发现肠道微生物群发出的信号能够影响巨噬细胞和肠神经元之间的交流,并改变肠道蠕动性。
结果
MM发育需要CSF1受体信号传导
肠道是一个复杂的分层结构,包括黏膜、黏膜下层和肌层(图1A)。肠道黏膜由两种主要的单核吞噬细胞亚群(CD103+CD11bCX3CR1°树突细胞和CD103 CD11b CX3CR1*巨噬细胞)组成,每种细胞具有不同的发育途径和功能(Bogunovic等人,2009,2012)。关于MMs的表型和功能知之甚少,主要是因为这些细胞很难从肠道组织中分离出来。一种将肠道肌层从覆盖的黏膜和黏膜下层分离出来的技术使我们能够使用全膜层组织制备和单细胞悬浮液对MMs进行详细分析。(Bogunovic等人,2009年)。通过结合流式细胞术和免疫荧光分析,我们展示了巨噬细胞(MMs)代表了一群异质性的MHCII+CD11c+CD103+CD11b+细胞(Bogunovic等人,2009年),这些细胞表达高水平的CX3CR1(图1A-1C)。巨噬细胞群体类似于CD103+CD11b+CX3CR1+巨噬细胞,这些细胞位于肠道固有层(LP)(Bogunovic等人,2009年)。在肠道细胞的悬浮液中,巨噬细胞可以通过CD11c的低表达和MHCII的高表达与CD11c LP吞噬细胞轻松区分(Bogunovic等人,2009年;图S1A在线可查)。
FLT3和CSF1(也称为巨噬细胞集落刺激因子[M-CSF])受体(CSF1R)是控制单核吞噬细胞发育的两个关键生长因子受体(Hashimoto等人,2011b)。我们之前已经证明CD103+CD11b+ LP巨噬细胞需要CSF1R信号来维持其稳态,并在Csf1r/-小鼠中减少(Bogunovic等人,2009年)。巨噬细胞与CD103+CD11b+ LP巨噬细胞之间的表型相似性促使我们研究CSF1R在巨噬细胞发育中的作用。我们发现巨噬细胞表达Csf1r(图1D),并且必须完全依赖于CSF1R信号,因为Csf1r/-小鼠缺乏这些细胞(图1E-1G)。此外,Csf1r/-骨髓(BM)祖细胞在移植到致死性辐射受体中时未能发育成巨噬细胞(图1H)。
为了研究巨噬细胞的功能,我们开发了一个模型,其中利用稳态特性选择性地耗尽巨噬细胞。我们发现巨噬细胞比LP吞噬细胞更依赖于CSF1R信号(图1G和1H),这为我们提供了一种策略,可以在不影响另一种细胞的情况下选择性地耗尽一种细胞。由于肠道中的CSF1R表达仅限于巨噬细胞和黏膜巨噬细胞(图S1B-S1D;小肠(SB)黏膜和黏膜下层[数据未显示]),单次腹腔内(i.p.)注射低剂量的阻断性抗CSF1R单克隆抗体(Sudo等人,1995年)(αCSF1R mAb)能够耗尽至少80%的巨噬细胞(图2A-2E,S2A和S2B),而不影响LP吞噬细胞(图2C,2D和S2B)或基质细胞(数据未显示)。巨噬细胞数量在抗体注射后24小时减少,并在7天后恢复正常(数据未显示)。在小肠和大肠(LB)(图2A-2E,S1C,S2A和S2B)中未观察到CSF1R水平在巨噬细胞或巨噬细胞耗尽效率上的差异。这种耗尽被认为是非炎症性的,因为在肌肉层或黏膜中没有淋巴细胞(图2F,S2C和S2D)、中性粒细胞或单核细胞(数据未显示)的募集。αCSF1R mAb的注射也没有增加肠道中的凋亡细胞数量(图S2E)。
综上所述,这些发现确定了CSF1R对巨噬细胞发育至关重要,并确立了体内阻断CSF1R作为这些细胞短暂耗尽的模型。
图2. 巨噬细胞(MM)耗尽的模型
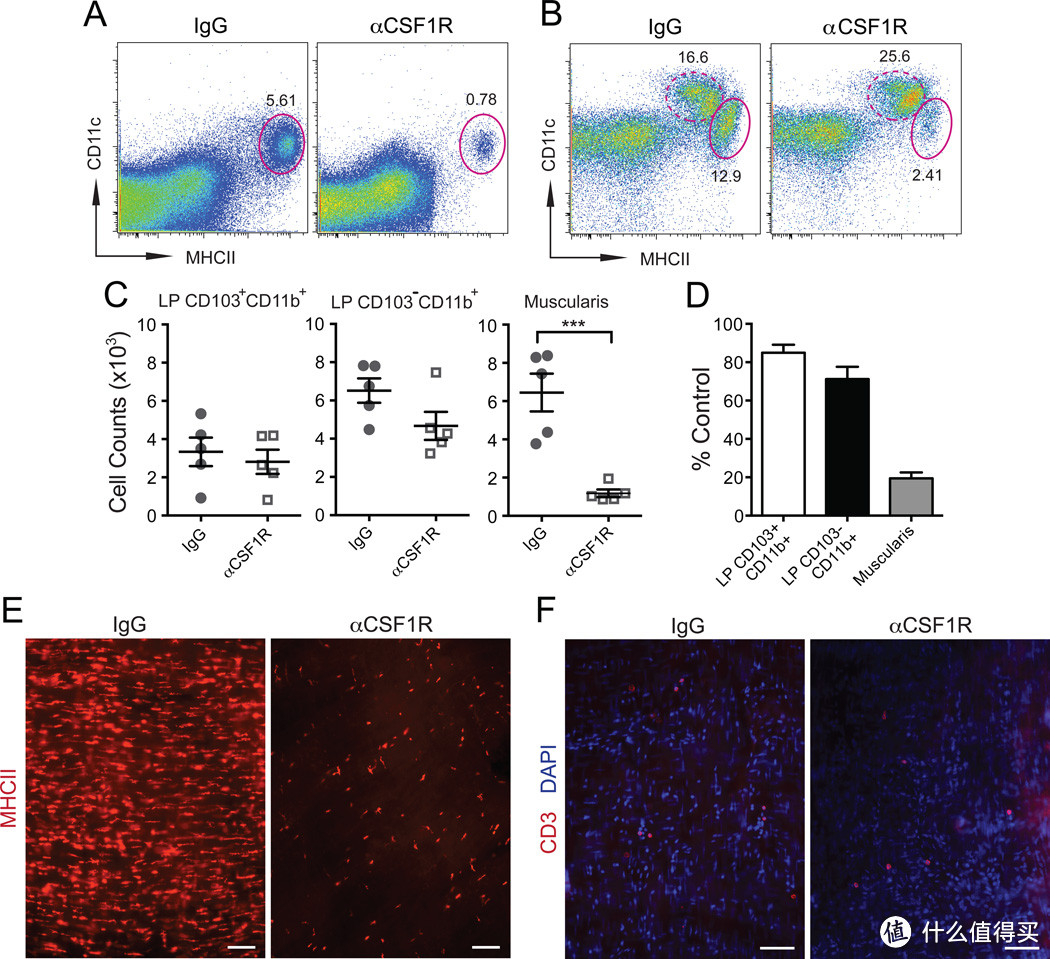
(A-B) 分离的小肠(SB)肌肉层的FACS图(A)和来自野生型(WT)小鼠在腹腔内(i. p.)注射同型IgG或αCSF1R单克隆抗体(mAb)两天后的全小肠(B)单细胞悬浮液的FACS图,显示了CD11c^loMHCII^hi MMs(椭圆形门,实线)和CD11c^hiMHCII^hi LP吞噬细胞(椭圆形门,虚线)的百分比。
A - 基于总活细胞的门控。
B - 使用图S1中的门控策略,基于CD45^+CD11c^lo/hiCD11b^hi细胞进行门控。
(C) 在WT小鼠的小肠中,腹腔内注射同型IgG或αCSF1R mAb两天后,通过FACS量化的LP CD103^+CD11b^+和LP CD103^+CD11b^+吞噬细胞和MMs(肌肉细胞)的绝对数量。
(D) 与同型IgG处理的小鼠相比,通过αCSF1R mAb处理的WT小鼠中LP吞噬细胞和MM数量的相对减少(第2天)。
(E-F) 通过免疫荧光分析(IF)分析WT小鼠在腹腔内注射同型IgG或αCSF1R mAb两天后MHCII^+巨噬细胞
(E)和CD3^+ T细胞
(F)在小肠肌肉中的分布。比例尺 - 100纳米。
MMs在稳定状态下调节胃肠道动力
在隔离的肠道中,可以通过向肠壁提供牵张力来引发蠕动反射(Frigo 和 Lecchini,1970年)。为了确定巨噬细胞(MMs)的条件性耗尽是否影响蠕动反射,我们开发了一种体外方法来记录对结肠环逐步牵张的蠕动收缩(图3A)。重复施加递增的牵张导致环立即收缩,随后逐渐放松,形成梯状的记录模式。增加的牵张产生了额外的高幅度收缩(进一步称为“牵张诱导收缩”),其幅度和频率逐渐增加(图3B)。在巨噬细胞耗尽的结肠环中,牵张诱导的收缩在较短的牵张时间内被引发,收缩更快,并且频率显著更高(图3B和3C);因此信号的均方根值(rms)增加(图3C和3D)。尽管体外结肠过度活跃,但通过珠子排出试验测量的结肠通过时间在巨噬细胞耗尽后增加,可能是因为肌肉收缩协调性差且效率低(图3E)。在其他肠道动力参数中,胃排空加速,而从小肠和大肠的通过时间以及总肠道通过时间没有显著变化(图S2F-S2H)。如果胃排空加速和SB和LB动力的延迟相互抵消,就会发生这种情况,这表明整个肠道的动力受到巨噬细胞耗尽的影响。
为了进一步确认巨噬细胞在调节肠道动力中的作用,我们生成了具有Csf1r/-/-基因的嵌合体小鼠,这些小鼠具有Csf1r-/-基因的肝细胞来源的祖细胞。一些Csf1r/-基因嵌合小鼠明显发展出结肠通过时间的延迟(图S2I);然而,Csf1r/-基因嵌合小鼠的嵌合不良和这些嵌合小鼠的低存活率不允许我们获得足够的动物进行统计比较。
总之,移除巨噬细胞导致运动障碍的观察表明,巨噬细胞有助于生理上调节肠道动力。
图3. 巨噬细胞(MMs)耗尽导致肠道运动障碍
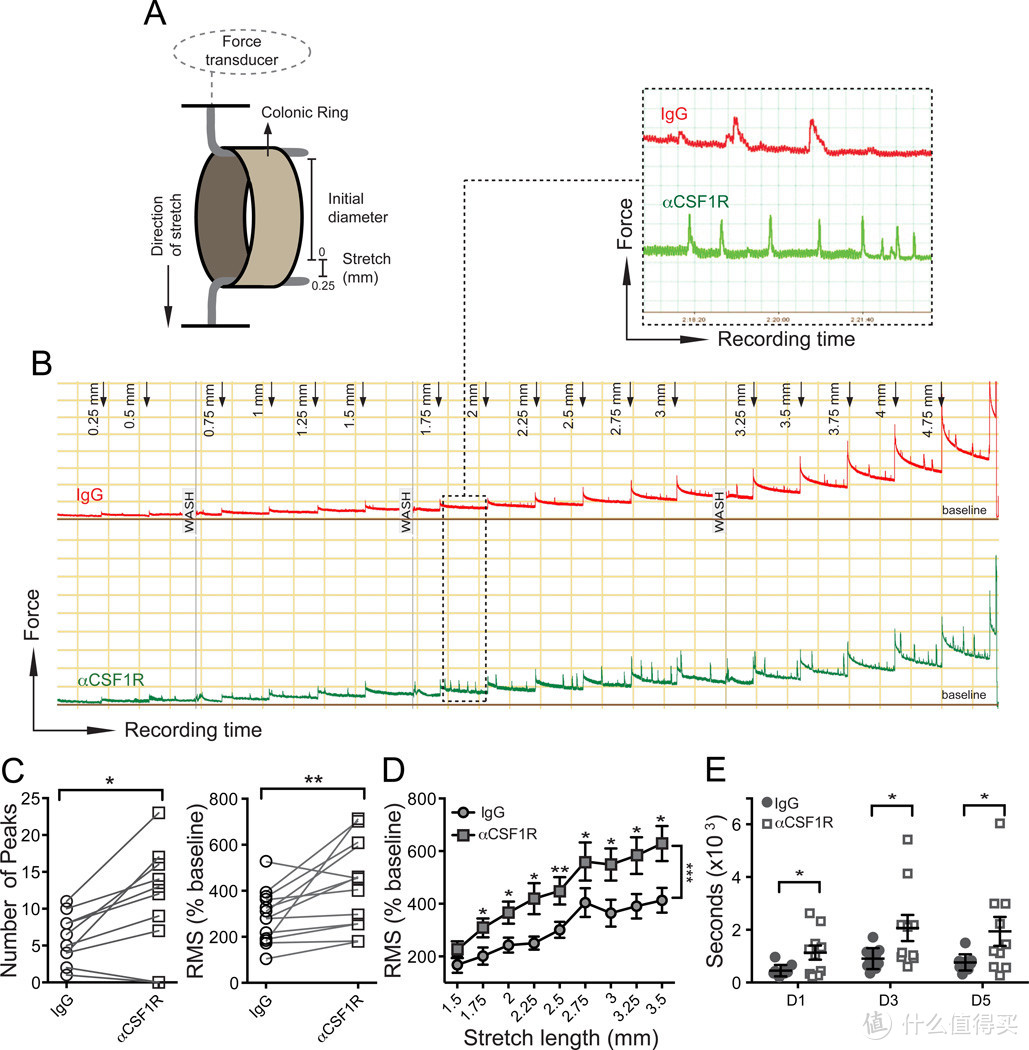
(A) 使用肌动描记仪测量结肠环在体外牵张诱导蠕动收缩的方法示意图。
(B) 在重复施加0.25毫米长至5.00毫米总牵张长度的牵张过程中,对结肠环进行5小时的牵张诱导收缩记录。3毫米结肠环来自野生型(WT)小鼠,在腹腔内(i.p.)注射同型IgG或αCSF1R单克隆抗体(mAb)两天后获得。
(C) 在10分钟的结肠牵张收缩记录中,结肠牵张距离为2.75毫米时,峰值数量(左)或归一化至基线的均方根值(RMS)百分比(右)。
(D) 在每个牵张步骤从1.5至3.5毫米的10分钟结肠收缩记录中,归一化至基线的均方根值(RMS)百分比。
(E) 在腹腔内注射同型IgG或αCSF1R mAb后1、3和5天,通过珠子排出试验测量野生型小鼠的结肠通过时间。
这段描述提供了一个实验的详细步骤,该实验旨在研究巨噬细胞耗尽对肠道蠕动功能的影响。实验中使用了肌动描记仪来记录结肠环在体外对牵张刺激的反应,并通过珠子排出试验来评估结肠的通过时间。实验对象为注射了同型IgG或αCSF1R单克隆抗体的野生型小鼠。
MMs通过BMP2的产生调节肠道蠕动
这些发现引发了一个问题:
巨噬细胞(MMs)是如何影响肠道动力的?
我们测试了最初的假设,即巨噬细胞分泌一种可溶性因子,这种因子会改变平滑肌的收缩性。为了识别编码潜在靶蛋白的基因,我们在不同的纯化肠道吞噬细胞亚群上进行了小鼠基因表达微阵列(Bogunovic等人,2009年,2012年),并进行了比较数据分析,以选择那些由巨噬细胞高度表达但与相关的CD103-CD11b+ LP巨噬细胞不表达的基因。骨形态发生蛋白2(BMP2)被确定为“前四名”中唯一一个非免疫基因,这些基因也编码了可溶性因子(Cd163、F13a1、Clec4e和Bmp2;图4A和4B)。没有其他BMP家族成员在任何肠道吞噬细胞亚群中表达(图4C和未显示的结果)。BMPs是转化生长因子β(TGF-b)超家族中的一组分泌蛋白,被认为主要控制器官发育(Hogan,1996年)。Bmp2-/-小鼠在胚胎期是致死的(Zhang和Bradley,1996年),而Bmp2+/-小鼠易受到低氧性肺动脉高压的影响,其特征是由于血管活性增加和结构重塑导致的肺动脉持续高压(Anderson等人,2010年)。BMP2在胎儿期(但不是成年期)肠道中高度表达,而BMP受体(BMPR)信号与肠平滑肌和神经元分化有关(Chalazonitis等人,2004年,2008年,2011年;Faure等人,2007年;Fu等人,2006年;Goldstein等人,2005年)。使用定量PCR(qPCR),我们确认了Bmp2在巨噬细胞中表达,但在纯化的肌肉淋巴细胞中不存在(图4D)。原位BMP2蛋白表达也仅限于MHCII+巨噬细胞(图4E)。为了检验BMP2是否在调节结肠动力中发挥作用,我们比较了体内用BMP受体信号抑制剂多索莫林(Yu等人,2008年)处理的小鼠和仅用载体处理的小鼠的结肠环牵张诱导收缩模式。dorsomorphin治疗引发了与巨噬细胞耗尽的小鼠结肠环中观察到的收缩过度活跃模式相似(图4F和S3A)。为了证实这种模式是由于BMP受体信号不足造成的,我们进行了一项“拯救”实验,在其中向巨噬细胞耗尽小鼠的结肠环中添加了递增浓度的外源性BMP2。BMP2以浓度依赖的方式减少了牵张诱导的收缩(图4G-4I)。当相同量的BMP2被添加到未耗尽巨噬细胞的结肠环中时,收缩性没有变化(图4G)。与我们的体外数据一致,BMP2注射部分加速了结肠转运时间(图4J)。
综合来看,我们的数据支持巨噬细胞分泌BMP2调节结肠收缩性的观点。
图4. 巨噬细胞(MMs)通过分泌BMP2调节肠道蠕动性
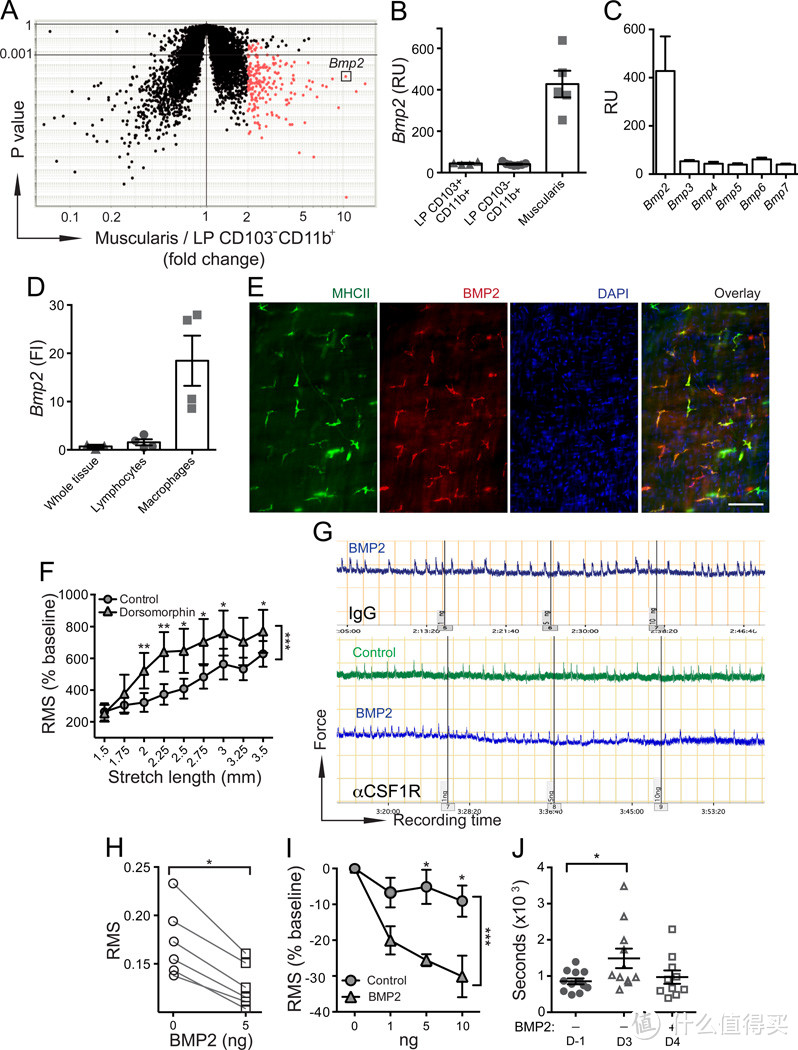
(A-B) 通过全小鼠基因组微阵列测量,比较了巨噬细胞(Muscularis)与CD103-CD11b+吞噬细胞
(A)以及CD103+CD11b+和CD103-CD11b+吞噬细胞
(B)中Bmp2基因表达水平。
(C) 通过全小鼠基因组微阵列测量巨噬细胞中Bmp2基因表达水平。
(D) 通过qPCR测量完整小肠(SB)肌肉层(整个组织)或从小肠肌肉层分离的SSCsCD45+CD11b-淋巴细胞和巨噬细胞中Bmp2相对基因表达水平。FI - 与“整个组织”相比的倍数增加。
(E) 对野生型(WT)小鼠的小肠肌肉进行免疫荧光(IF)分析,使用抗BMP2和抗MHCII单克隆抗体染色,并用DAPI进行对比染色。比例尺 - 100纳米。
(F) 在1.5-3.5毫米的牵张间隔下,将结肠收缩记录的均方根值(RMS)归一化至基线(%)。从用BMP受体抑制剂多索莫林或对照载体处理的野生型小鼠中获得3毫米结肠环。
(G) 野生型小鼠腹腔内(i.p.)注射同型IgG(顶部)或αCSF1R单克隆抗体(底部),并在2天后进行分析。面板显示了这些小鼠在添加1、5和10纳克人类重组BMP2或对照载体(在2.75毫米“最佳”牵张距离下进行)之前和之后的体外牵张诱导收缩记录。
(H) 在F中描述的10分钟记录的均方根值(底部面板,αCSF1R mAb处理小鼠)在添加5纳克BMP2
(I)之前和之后。基线这里是指在添加BMP2或对照载体之前的相同牵张距离(2.75毫米)的记录。
(J) 在接受αCSF1R单克隆抗体(第-1天)之前和接受αCSF1R单克隆抗体后第3天和第4天,通过珠子排出试验测量野生型小鼠的结肠通过时间;在最后一次评估前18和3小时,小鼠接受了1微克BMP2腹腔内注射(i.p.)。
MMs激活表达BMPR受体的肠内神经元
我们接下来试图识别巨噬细胞(MMs)衍生的BMP2所靶向的细胞。平滑肌对外界刺激(牵张或钾离子电流(KCl))的收缩力在巨噬细胞耗尽后(图S3B和S3C)未受影响。CKit+ 肠间质细胞(ICC)和βIII型肌管蛋白+肠神经鞘(ENS)网络没有重叠(图S4A)。ICC和ENS网络在MP耗尽后仍然完整(图S5C和S3D),这表明急性巨噬细胞耗尽并不会在解剖学上破坏ICCs或ENS。上皮血清素+肠内分泌细胞的数量,这些细胞激活对腔内信号的蠕动反射(Bulbring和Crema,1959a, 1959b; Heredia等人,2013年),在注射αCSF1R单克隆抗体(mAb)后也未受影响(图S3E和S3F)。此外,即使在用最大剂量的αCSF1R mAb处理后,肠上皮的通透性仍然未受影响(图S3G和S3H)。我们评估了巨噬细胞和肠神经元之间的解剖学相互作用,发现绝大多数巨噬细胞沿着神经纤维定位,通常形成紧密接触(图5A)。BMP2通过I型和II型丝氨酸激酶(分别为BMPRIa和BMPRII)的寡聚化传递信号,这些激酶形成BMP受体(Kirsch等人,2000年)。我们发现BMPRII被βIII型肌管蛋白标记的神经元选择性表达(图5B),但不是ICCs(cKit+;图S4B)或与ENS相关的胶质细胞(GFAP+;图S4C),这表明巨噬细胞作用于肠神经元。配体结合到BMPR激活经典信号通路,通过SMAD1、5和8的磷酸化和核转位(Derynck和Zhang,2003年)。用重组BMP2处理培养的原代肠神经元,这些神经元表达BMPRa和BMPRII,但不是BMPRb和BMP2(图S4D),导致pSMAD1/5/8复合体在神经元核中的快速积累(图S4E)。此外,大多数BMPRII+肠神经元的核在体内呈pSMAD1/5/8阳性,证明通过BMPR的激活在持续发生(图S5C和5D)。相比之下,巨噬细胞耗尽导致体内大多数肠神经元的pSMAD1/5/8从核中消失,这与巨噬细胞对BMPR信号传递的关键贡献一致(图S5C和5D)。在缺乏巨噬细胞的肌肉层中加入外源性BMP2,恢复了具有pSMAD1/5/8未激活核的肠神经元数量接近正常水平(图S5C和5D)。
这些数据表明,巨噬细胞通过分泌BMP2为神经元提供持续信号,激活它们所表达的BMP受体。
图5. 巨噬细胞(MMs)激活肠神经元上的BMP2受体
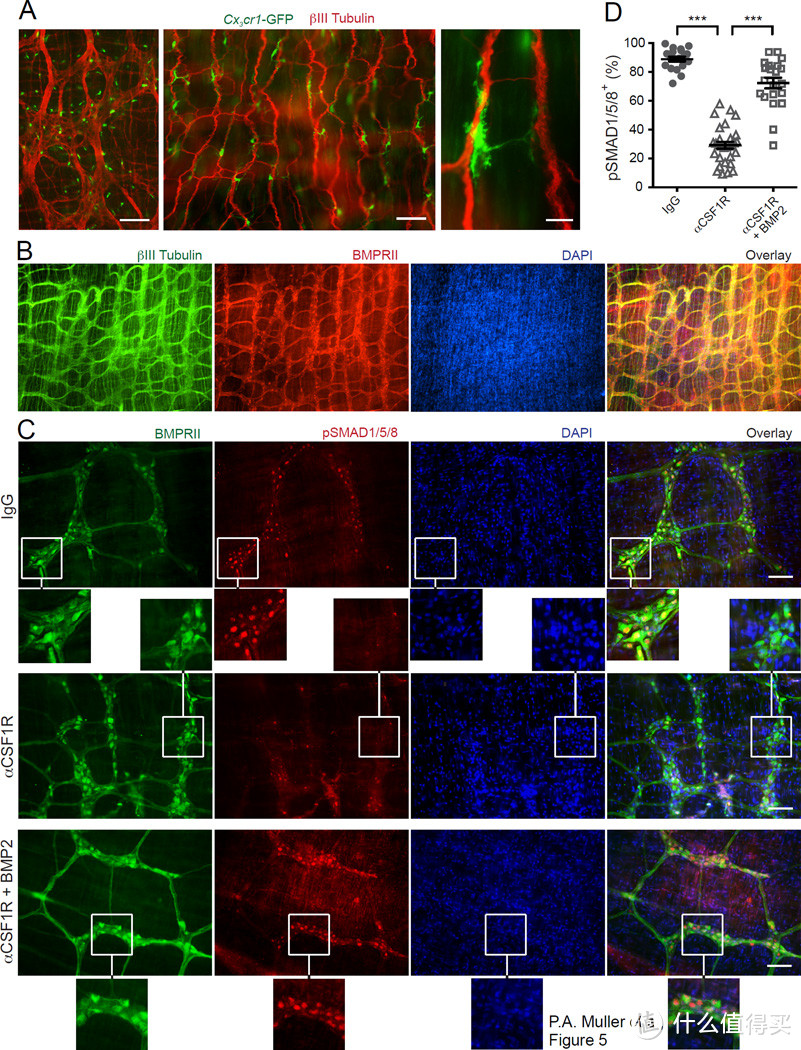
(A) 在Cx3cr1-GFP+/-小鼠的结肠(左)和回肠(中和右)肌肉层中CX3CR1+巨噬细胞的分布,使用抗βIII型微管蛋白抗体染色并通过免疫荧光(IF)分析。比例尺 - 500纳米(左),100纳米(中)和10纳米(右)。
(B) 对野生型(WT)小鼠的小肠肌肉层进行免疫荧光(IF)分析,使用抗BMPRII和抗βIII型微管蛋白抗体染色,并用DAPI进行对比染色。比例尺 - 500纳米。
(C) 对野生型小鼠的小肠肌肉层进行免疫荧光(IF)分析,2天后腹腔内(i.p.)注射同型IgG(顶部),αCSF1R单克隆抗体(中间和底部)染色,使用抗pSMAD1/5/8和抗BMPRII抗体染色,并用DAPI进行对比染色。底部面板显示了αCSF1R mAb注射小鼠肌肉层中pSMAD1/5/8分布,该小鼠的处理方法如D部分所述。比例尺 - 100纳米。
(D) 对野生型小鼠肌肉层中pSMAD1/5/8+BMPRII+神经元分布的定量总结,这些小鼠在腹腔内注射同型IgG或αCSF1R mAb后2天。在所有情况下,肌肉层在37°C的完整培养基中孵育30分钟,存在或不存在BMP2(10纳克/毫升)如所示。每个数据点代表每个视野中pSMAD1/5/8+神经元占总BMPRII+神经元的百分比;每列总结了三只动物的结果。
肠内神经元产生巨噬细胞生长因子CSF1
CSF1和白细胞介素-34(IL-34)是激活CSF1R的两种替代配体(Lin等,2008;Yeung等,1987),这些细胞因子每一种都与不同巨噬细胞群体的发育有关(Greter等人,2012年;Hashimoto等人,2011b年;Wang等人,2012年)。巨噬细胞(MMs)不表达CSF1(图1A)或IL-34(数据未显示),这表明CSF1和IL-34必须由不同的细胞群体产生,可能是基质细胞。CSF1和IL-34由出生后大脑中成熟的神经元的不同亚型交替表达(Nandi等人,2012年)。因此,我们问题在于肠神经元和巨噬细胞之间是否存在额外的交流,其中肠神经元为巨噬细胞提供CSF1R配体。我们发现肠神经元在培养中表达CSF1,但不表达IL-34(图6A和6B),并且是肌肉层中CSF1蛋白的主要来源(图6C)。正如预期,并且与早期报告一致(Mikkelsen和Thuneberg,1999年),CSF1缺乏的Csf1op/op小鼠几乎完全缺乏巨噬细胞(图6D-6F)。
这些结果表明,肠神经元可能在维持巨噬细胞稳态中发挥关键作用。
Csf1op/op小鼠的骨缺陷,包括无牙(Wiktor-Jedrzejczak等人,1991年)以及它们显著较小的尺寸(图S5A),阻止了我们分析这些动物的肠道动力。然而,我们观察到,尽管Csf1op/op小鼠的肠道长度和直径都较小(小肠长度SB:WT的80%[Huynh等人,2009年];大肠长度LB:WT的80%),这些动物的盲肠比WT小鼠大(图S5B),这表明Csf1op/op小鼠的肠道动力失调。
与我们使用短暂巨噬细胞耗尽模型获得的数据一致,我们发现与WT同胞相比,Csf1op/op小鼠结肠中的pSMAD1/5/8+肠神经元数量显著减少(图6G和S5C)。我们还观察到Csf1op/op小鼠肠神经元总数显著增加,同时ENS的组织结构不够有序(图6H和6I),这表明巨噬细胞在ENS发育中的重要性。这一观察与关于NS/E-noggin小鼠的先前发现相似,这些小鼠在神经元特异性酶(NSE)启动子的控制下过表达内源性BMP抑制剂noggin(Chalazonitis等人,2004年;Chalazonitis等人,2008年)。
图6 肠神经元产生MM发育所需的CSF1
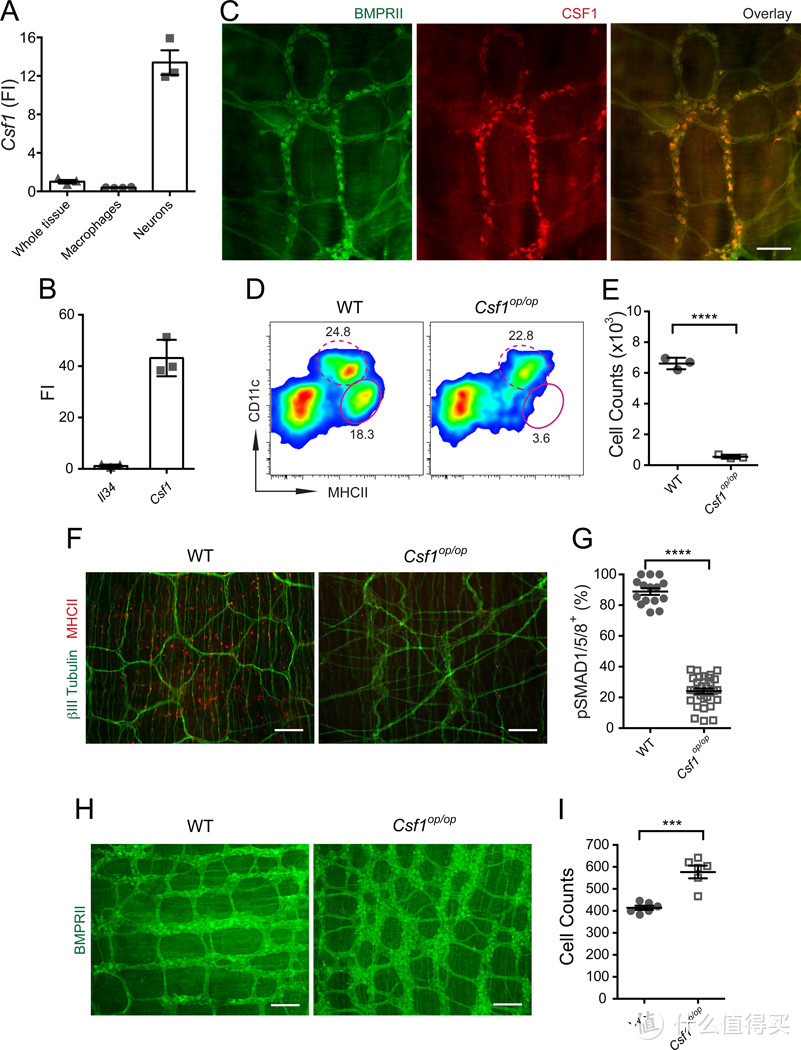
(A)通过qPCR在完整肌层(整个组织)、从SB肌层分选的巨噬细胞和培养的原代肠神经元中测量的CSF1基因表达水平(FI与“整个组织”相比)。
(B) 与Il-34相比,通过qPCR在培养的肠神经元中测量的Il-34和Csf1相对基因表达水平(FI)。
(C) 用抗BMPRII和抗CSF1抗体染色的WT小鼠LB肌层的IF分析。比例尺–100 nm。
(D) 来自WT小鼠及其Csf1op/op同窝小鼠的全肠单细胞悬浮液的FACS图显示了CD11cloMHCIHi-MM(卵圆门,实线)和CD11chiMHCIHi-LP吞噬细胞(卵圆门,虚线)的百分比。门控CD45+CD11clo/hiCD11blo/hi细胞
(E)通过FACS定量WT小鼠和Csf1op/op小鼠肠道中的绝对MM数量。
(F) 用抗βIII微管蛋白和抗MHCII抗体染色的WT小鼠及其Csf1op/op同窝小鼠的LB(盲肠)肌层的IF分析。比例尺–500 nm。
(G) WT和Csf1op/op小鼠LB肌层中pSMAD1/5/8+BMPRII+神经元分布的定量总结。每个数据点代表每个视野中总BMPRII+神经元中pSMAD1/5/8+神经元的百分比;每列总结了三只动物的结果。
(H) 用抗BMPRII抗体染色的WT和Csf1op/op同窝的LB(结肠)肌层的IF分析。比例尺-500 nm。
(I) 野生型和Csf1op/op小鼠结肠中BMPRII+神经元分布的定量总结。每个数据点代表每个视野中BMPRII+神经元的计数;每列总结了两只动物的结果。
肠腔微生物调节巨噬细胞-神经元交流
肠道微生物群似乎对于肠道蠕动的正常调节至关重要,而在无菌啮齿类动物(Abrams和Bishop,1967年;Gustafsson等人,1970年)以及TLR4-/-和Myd88-/-小鼠(Anita等人,2012年)中已经描述了严重的运动障碍。调节肠道蠕动的机制尚不清楚,可能涉及许多不同类型的细胞的异常。无菌、抗生素处理的TLR4-/-和Myd88-小鼠的肠道蠕动减慢伴随着肠神经元表型多样性的改变,以及氮能神经元数量的减少(Anitha等人,2012年)。巨噬细胞是否对这些调节过程有贡献尚不清楚。与已发表的报告类似(Abrams和Bishop,1967年;Anitha等人,2012年;Gustafsson等人,1970年),我们发现用广谱抗生素治疗的小鼠肠道蠕动严重紊乱(图7A、S6A和S6B)。巨结肠也发生在这些动物中(图S7E),因此,珠子排出试验对于测量结肠蠕动性没有价值。在进行体外分析时,我们发现抗生素治疗的小鼠结肠环显示出与巨噬细胞耗尽或多索莫林处理的小鼠结肠环相似的收缩过度活跃模式(图7B和S6C)。引人注目的是,我们发现与对照小鼠相比,抗生素治疗的小鼠Bmp2表达显著减少(图7C),这表明微生物群落影响巨噬细胞和肠神经元之间的相互作用。同样,与仅接受水的对照组小鼠相比,抗生素治疗的小鼠pSMAD1/5/8+肠神经元数量显著减少(图7D和S6D)。然后,我们质疑共生信号是否也可以调节肠神经元的CSF1产生。我们发现,向培养的原代肠神经元中添加泛菌糖脂质(LPS)增加了它们的Csf1表达(图7E),而在存在外源性BMP2的情况下培养原代肠神经元并不影响Csf1表达水平(数据未显示)。同样,体内抗生素治疗降低了结肠肌肉层中的Csf1表达(图7F),尽管Csf1减少的动力学缓慢,并在治疗4周后达到最低值(图S7A)。与Csf1减少一致,抗生素治疗也导致巨噬细胞数量减少(图7G、S7B和S7C),具有相似的动力学(图S7B)。在抗生素治疗过程中没有观察到黏膜巨噬细胞数量的减少(数据未显示)。此外,产生黏膜巨噬细胞(Bogunovic等人,2009年)和巨噬细胞(M.B.,未发表的数据)的Gr1hi血液单核细胞的数量没有受到影响,从而排除了对BM中髓系细胞发育的影响(图S7D)。
影响肠道蠕动的微生物群相关因素包括营养分解的组成部分、微生物代谢的副产品以及微生物细胞成分,如LPS(Reigstad和Kashyap,2013年)。虽然盲肠增大是抗生素治疗的早期迹象,但盲肠大小在治疗过程中持续增加(图S7E),这意味着各种微生物群相关因素以不同的动力学对抗生素诱导的运动障碍有贡献。Csf1表达和巨噬细胞数量的减少动力学与抗生素处理期间肠道腔细菌的减少相比有所延迟(图S7F),这表明在长期抗生素治疗后血清LPS减少(Anitha等人,2012年)可能是这些变化的原因。为了验证这一点,我们在维持抗生素的同时,按照之前描述的方法(Rakoff-Nahoum等人,2004年)在饮用水中补充了LPS。与体外数据和我们的假设一致,LPS补充防止了Csf1表达和巨噬细胞数量的减少(图7F、7G和S7C)。补充LPS也部分改善了胃肠道的转运时间(图7H),并减少了盲肠的大小(图S7G)。
接下来,我们询问巨噬细胞-神经元交流是否可逆。抗生素处理的小鼠通过从未经处理的对照小鼠进行粪便转移(FT)重新引入微生物群。恢复肠道腔细菌到接近正常水平(图S7H)能够恢复肠道中的Csf1表达(图7F)和巨噬细胞数量(图7G),并纠正运动障碍和盲肠大小(图7I)。
综合这些结果表明,巨噬细胞-神经元交流的两个组成部分的功能都可以通过腔内共生信号可逆地调节。
图7. 肠腔微生物群调节肠道蠕动性和巨噬细胞-神经元交流 (A-D) 野生型(WT)小鼠饮用含抗生素的水4周,对照年龄匹配的小鼠仅饮用水。
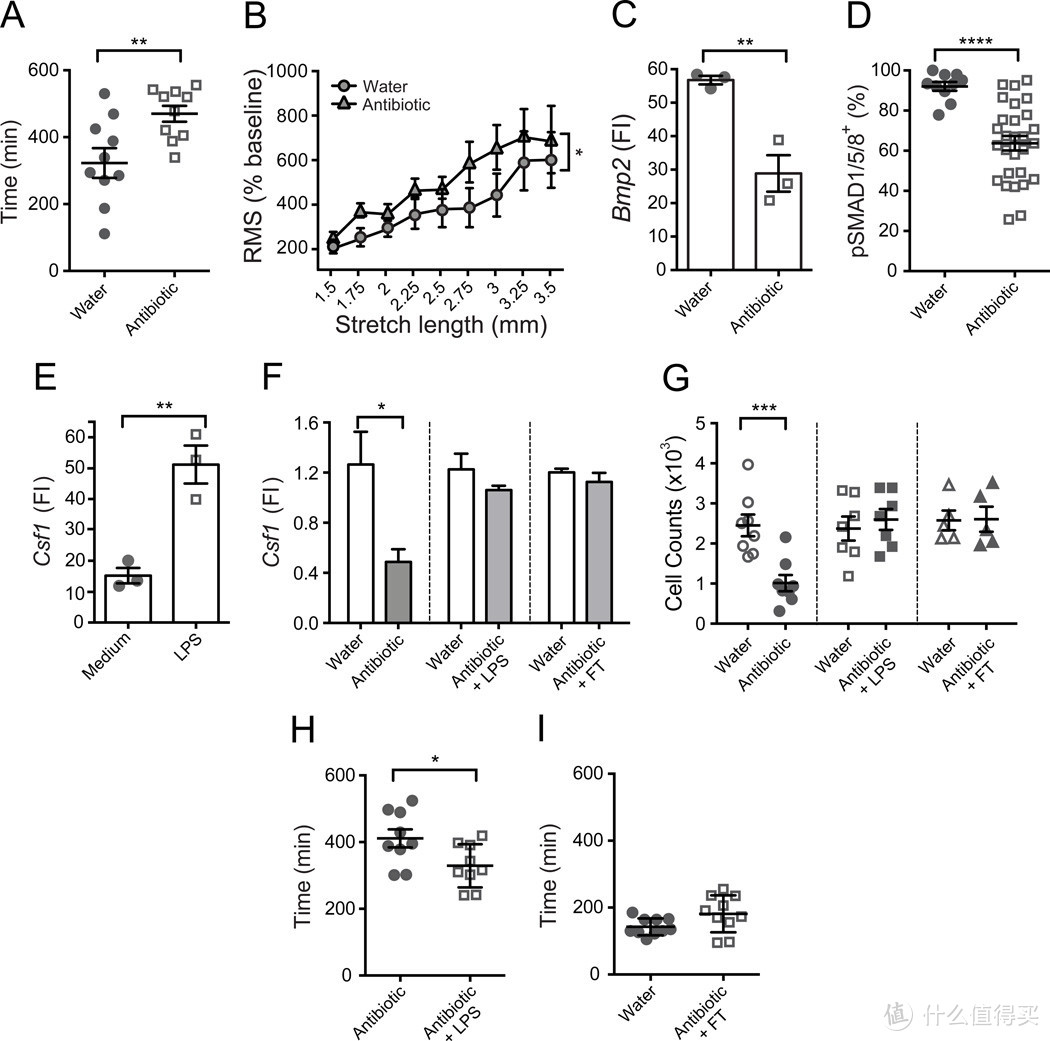
(A) 总肠道通过时间,代表排出含有卡明红染料粪便所需的时间,在抗生素处理的小鼠和对照小鼠中测量。
(B) 在1.5-3.5毫米的牵张间隔下,结肠收缩记录的均方根值(RMS)归一化至基线(%)。从抗生素处理和对照小鼠中获得3毫米结肠环。
(C) 通过qPCR测量从分离的小肠肌肉层抗生素处理和对照小鼠中分选的巨噬细胞中Bmp2相对基因表达水平。FI - 与完整肌肉层中的Bmp2水平相比的倍数增加。每个数据点代表从5只小鼠中单次分选后分析50,000个细胞的qPCR结果。每组的细胞分选在同一天、相同条件下成对进行。
(D) 小肠肌肉层中pSMAD1/5/8+BMPRII+神经元分布的定量总结,来自抗生素处理和对照小鼠。每个数据点代表每个视野中pSMAD1/5/8+神经元占总BMPRII+神经元的百分比;每列总结了三只动物的结果。
(E) 通过qPCR测量培养的原代肠神经元中Csf1相对基因表达水平。分化神经元在分析前18小时有或没有10纳克/毫升LPS培养。FI - 与完整肌肉层中的Csf1水平相比的倍数增加。每个数据点代表来自独立神经元培养的qPCR结果。FI - 与完整肌肉层中的Csf1水平相比的倍数增加。
(F) 通过qPCR在抗生素处理4周的WT小鼠的小肠肌肉层中量化Csf1相对基因表达水平(左),与抗生素和50微克/毫升LPS饮用水处理4周的WT小鼠(中),以及在4周抗生素处理后3周接受粪便转移(FT)的WT小鼠(右)。数据与仅饮用水的对照组进行比较。FI - 与仅饮水的对照组中平均Csf1水平相比的倍数增加。
(G) 通过FACS在抗生素处理的WT小鼠的小肠肌肉层中量化的巨噬细胞绝对数量(左),抗生素和LPS(中),以及在抗生素处理后(右),与仅饮用水的对照小鼠相比。
(H) 抗生素处理的WT小鼠在饮用含50微克/毫升LPS的水4周和仅接受抗生素4周的同龄小鼠的总肠道通过时间。
(I) 在4周抗生素处理后3周接受FT的WT小鼠和仅饮用水的对照小鼠的总肠道通过时间。
感谢
我们感谢Immgen项目(http://www.immgen.org)的成员们执行了全小鼠基因组微阵列分析,以及宾夕法尼亚州立大学Hershey流式细胞术核心设施和西奈山流式细胞术核心对我们实验的帮助。我们还要感谢Frederico Costa Pinta(纽约Rockefeller大学和巴西圣保罗大学兽医学院)、Hongyan Zou(纽约西奈山医学院)、Florent Ginhoux(新加坡免疫网络和科技研究局)就本研究进行了富有成效的讨论,以及Aron Lukacher(宾夕法尼亚州立大学医学院Hershey,PA)对手稿的帮助。这项工作部分得到了美国国立卫生研究院NIH(AI09561, CA173861, 和 AI104848 M.M; CA32551 至E.R.S; 以及R21-AI105 D.M.)的资助,以及来自CCFA和NIAID(M.B.)的职业发展奖。
参考文献:
1.Aberle, H., Haghighi, A.P., Fetter, R.D., McCabe, B.D., Magalha˜ es, T.R., and Goodman, C.S. (2002). wishful thinking encodes a BMP type II receptor that regulates synaptic growth in Drosophila. Neuron 33, 545–558.
2.Abrams, G.D., and Bishop, J.E. (1967). Effect of the normal microbial flora on gastrointestinal motility. Proc. Soc. Exp. Biol. Med. 126, 301–304.
3.Anderson, L., Lowery, J.W., Frank, D.B., Novitskaya, T., Jones, M., Mortlock,D.P., Chandler, R.L., and de Caestecker, M.P. (2010). Bmp2 and Bmp4 exert opposing effects in hypoxic pulmonary hypertension. Am. J. Physiol. Regul. Integr. Comp. Physiol. 298, R833–R842.
4.Anitha, M., Vijay-Kumar, M., Sitaraman, S.V., Gewirtz, A.T., and Srinivasan, S.(2012). Gut microbial products regulate murine gastrointestinal motility via Toll-like receptor 4 signaling. Gastroenterology 143, 1006–1016.e4.
5.Boeckxstaens, G.E., and de Jonge, W.J. (2009). Neuroimmune mechanisms in postoperative ileus. Gut 58, 1300–1311.
6.Bogunovic, M., Dave´ , S.H., Tilstra, J.S., Chang, D.T., Harpaz, N., Xiong, H.,Mayer, L.F., and Plevy, S.E. (2007). Enteroendocrine cells express functional Toll-like receptors. Am. J. Physiol. Gastrointest. Liver Physiol. 292, G1770–G1783.
7.Bogunovic, M., Ginhoux, F., Helft, J., Shang, L., Hashimoto, D., Greter, M., Liu,K., Jakubzick, C., Ingersoll, M.A., Leboeuf, M., et al. (2009). Origin of the lamina propria dendritic cell network. Immunity 31, 513–525.
8.Bogunovic, M., Mortha, A., Muller, P.A., and Merad, M. (2012). Mononuclear phagocyte diversity in the intestine. Immunol. Res. 54, 37–49.
9.Bulbring, E., and Crema, A. (1959a). The action of 5-hydroxytryptamine,5-hydroxytryptophan and reserpine on intestinal peristalsis in anaesthetized guinea-pigs. J. Physiol. 146, 29–53.
10.Bulbring, E., and Crema, A. (1959b). The release of 5-hydroxytryptamine in relation to pressure exerted on the intestinal mucosa. J. Physiol. 146, 18–28.Chalazonitis, A., D’Autre´ aux, F., Guha, U., Pham, T.D., Faure, C., Chen, J.J.,Roman, D., Kan, L., Rothman, T.P., Kessler, J.A., and Gershon, M.D. (2004).Bone morphogenetic protein-2 and -4 limit the number of enteric neurons but promote development of a TrkC-expressing neurotrophin-3-dependent subset. J. Neurosci. 24, 4266–4282.
11.Chalazonitis, A., Pham, T.D., Li, Z., Roman, D., Guha, U., Gomes, W., Kan, L.,Kessler, J.A., and Gershon, M.D. (2008). Bone morphogenetic protein regulation of enteric neuronal phenotypic diversity: relationship to timing of cell cycle exit. J. Comp. Neurol. 509, 474–492.
12.Chalazonitis, A., D’Autre´ aux, F., Pham, T.D., Kessler, J.A., and Gershon, M.D.(2011). Bone morphogenetic proteins regulate enteric gliogenesis by modu lating ErbB3 signaling. Dev. Biol. 350, 64–79.
13.Chow, A., Lucas, D., Hidalgo, A., Me´ ndez-Ferrer, S., Hashimoto, D., Scheier mann, C., Battista, M., Leboeuf, M., Prophete, C., van Rooijen, N., et al. (2011).Bone marrow CD169+ macrophages promote the retention of hematopoietic stem and progenitor cells in the mesenchymal stem cell niche. J. Exp. Med.208, 261–271.
14.Chow, A., Huggins, M., Ahmed, J., Hashimoto, D., Lucas, D., Kunisaki, Y.,Pinho, S., Leboeuf, M., Noizat, C., van Rooijen, N., et al. (2013). CD169+ mac rophages provide a niche promoting erythropoiesis under homeostasis and stress. Nat. Med. 19, 429–436.
15.Dahan, S., Rabinowitz, K.M., Martin, A.P., Berin, M.C., Unkeless, J.C., and Mayer, L. (2011). Notch-1 signaling regulates intestinal epithelial barrier function, through interaction with CD4+ T cells, in mice and humans. Gastro enterology 140, 550–559.
16.Derynck, R., and Zhang, Y.E. (2003). Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature 425, 577–584.
17.Eaton, B.A., and Davis, G.W. (2005). LIM Kinase1 controls synaptic stability downstream of the type II BMP receptor. Neuron 47, 695–708.
18.Eaton, B.A., Fetter, R.D., and Davis, G.W. (2002). Dynactin is necessary for synapse stabilization. Neuron 34, 729–741.
19.Faure, C., Bouin, M., and Poitras, P. (2007a). Visceral hypersensitivity in irritable bowel syndrome: does it really normalize over time? Gastroenterology 132,464–465, author reply 465.
20.Faure, C., Chalazonitis, A., Rhe´ aume, C., Bouchard, G., Sampathkumar, S.G.,Yarema, K.J., and Gershon, M.D. (2007b). Gangliogenesis in the enteric nervous system: roles of the polysialylation of the neural cell adhesion molecule and its regulation by bone morphogenetic protein-4. Dev. Dyn. 236, 44–59.
21.Flores-Langarica, A., Meza-Perez, S., Calderon-Amador, J., Estrada-Garcia,T., Macpherson, G., Lebecque, S., Saeland, S., Steinman, R.M., and FloresRomo, L. (2005). Network of dendritic cells within the muscular layer of the mouse intestine. Proc. Natl. Acad. Sci. USA 102, 19039–19044.
22.Frigo, G.M., and Lecchini, S. (1970). An improved method for studying the peristaltic reflex in the isolated colon. Br. J. Pharmacol. 39, 346–356.
23.Fu, M., Vohra, B.P., Wind, D., and Heuckeroth, R.O. (2006). BMP signaling regulates murine enteric nervous system precursor migration, neurite fasciculation, and patterning via altered Ncam1 polysialic acid addition. Dev. Biol.299, 137–150.
等等
关于研究主题相关信息的补充:
(Cell 158, 300–313; July 17, 2014)
在上述文章中,我们加入了一个用于消耗肌层巨噬细胞的抗csf1r单克隆抗体剂量的错误测量单位。正确的剂量是体重的剂量为37.5毫克/克(微克/克),如实验程序所述。消耗所有肠道巨噬细胞的最大剂量为150 mg/g体重,如图3g的图例所示。这篇文章已经在网上更正了。
免责声明:
以上部分内容来源于外网我们重在信息分享,版权归属原作者或原刊发平台所有,如有侵权、信息有误或其他异议,请联系我们,我们将在24小时内删除或整改。